As oxigenases são uma categoria de proteínas que foram descobertas em 1955 pelos bioquímicos Osamu Hayashi (Japão) e Howard S. Mason (EUA). Desde então, a proteína sempre foi relacionada a importantes atividades do organismo, como tumores, processos anti-inflamatórios e regulação de transcrição gênica, desempenhando, portanto, um papel chave para o funcionamento de nosso organismo.
Durante seu pós-doutorado na Universidade de Oxford (Inglaterra), o docente do Instituto de Física de São Carlos (IFSC/USP), João Renato Carvalho Muniz, focou sua pesquisa em oxigenases dependentes de 2-oxoglutarato (2OG), que também assume importante papel na manutenção do organismo. Por sua prática na resolução de estruturas proteicas humanas, adquirida durante o pós-doutoramento, João Renato conseguiu desvendar a estrutura tridimensional da oxigenasse 2-oxoglutarato (2OG) dependente e, em conjunto com outros pesquisadores de Oxford, fez uma interessante descoberta que rendeu, inclusive, a publicação de um artigo na notória revista Nature *: a 2-oxoglutarato (2OG) dependente mostrou-se similar a muitas outras enzimas, inclusive às encontradas em células procariotas, células de organismos unicelulares, como algumas bactérias. Ou seja, uma proteína com papel chave foi encontrada tanto em células de humanos como em células de seres considerados inferiores. “A constatação de que essas proteínas ocorrem em organismos que vão de procariotos a eucariotos levanta questões quanto às suas relações estruturais e evolutivas”, conta João Renato.
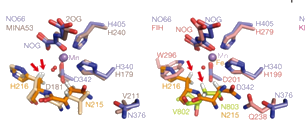 Mas, esse não foi o fato mais impactante da descoberta: os pesquisadores de Oxford também notaram sutis mudanças adaptativas na estrutura das 2-oxoglutarato (2OG) dependentes com o intuito de conservar seu sítio de ligação ao elemento químico Ferro (Fe), na ausência do grupo heme. “A natureza utiliza uma multiplicidade de estratégias para isso e a definição dos princípios gerais de evolução da seletividade de metais em sistemas biológicos representa ainda um desafio”, comenta João Renato.
Mas, esse não foi o fato mais impactante da descoberta: os pesquisadores de Oxford também notaram sutis mudanças adaptativas na estrutura das 2-oxoglutarato (2OG) dependentes com o intuito de conservar seu sítio de ligação ao elemento químico Ferro (Fe), na ausência do grupo heme. “A natureza utiliza uma multiplicidade de estratégias para isso e a definição dos princípios gerais de evolução da seletividade de metais em sistemas biológicos representa ainda um desafio”, comenta João Renato.
O estudo, de caráter básico, é o pontapé inicial para saber, por exemplo, onde, exatamente, acontecem as principais reações em uma célula, ou seja, descobrir qual é seu sítio ativo. O desenvolvimento de outras informações também é de igual importância. “O 2-oxoglutarato é um ligante chave para as oxigenases, que têm um papel importante em diversos processos fisiológicos, principalmente relacionados à regulação da expressão gênica, na hidroxilação de fatores de transcrição e nos processos de transcrição de DNA. A partir do momento que entendermos o funcionamento correto desse substrato, poderemos propor novos fármacos para cura de diversas doenças, como anemia, inflamações e, até mesmo, câncer”, elucida o docente.
O próximo passo dessa pesquisa é justamente desenvolver inibidores, novos fármacos, fertilizantes, entre outras coisas, desenvolvimento que será baseado no entendimento sobre esses ligantes microscópicos. “Esses resultados são o ‘trampolim’ para diversos outros estudos aplicados. No entanto, sem essa informação, que é básica e primordial, não seria possível andar em direção a descobertas maiores”, afirma João Renato. “Porém, nesse contexto, os descobrimentos mais importantes tiveram início a partir do discernimento de coisas muito pequenas”, conclui.
*O artigo abordou estudos comparativos envolvendo 15 estruturas cristalográficas de organismos procarióticos, como as bactérias Escherichia coli e Rhodothermus marinus, assim como as de organismos superiores, como o Homo sapiens
Assessoria de Comunicação




