Não é preciso ser um grande biólogo para saber que os seres vivos, desde sua origem, continuamente evoluem em termos físicos. Mas, entender como essa evolução ocorre até os dias de hoje, é trabalhosa e muitas vezes incompreensível, até mesmo para os mais renomados estudiosos.
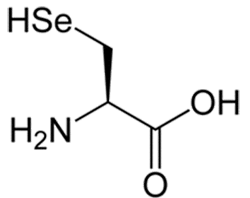 Uma das dúvidas que paira a esse respeito é o porquê de somente bactérias possuírem em seu organismo uma enzima de estrutura extremamente complexa, chamado Selenocisteína Sintase (SelA), qual sua principal função nesses micro-organismos e por que seres de organização biológica mais complexa, como os humanos, não a possuem.
Uma das dúvidas que paira a esse respeito é o porquê de somente bactérias possuírem em seu organismo uma enzima de estrutura extremamente complexa, chamado Selenocisteína Sintase (SelA), qual sua principal função nesses micro-organismos e por que seres de organização biológica mais complexa, como os humanos, não a possuem.
Nesse contexto, o aluno de doutorado do Instituto de Física de São Carlos (IFSC/USP), Vitor Hugo Balasco Serrão, orientado pelo docente Otavio Henrique Thiemann, tem estudado, desde seu mestrado, técnicas capazes de desvendar a estrutura proteica da SelA e entender outros aspectos importantes relacionados a ela.
Até o momento, uma das descobertas referentes à SelA é o fato desta possuir 5 tRNAs que se ligam à sua cadeia proteica, algo que foi observado por microscopia eletrônica em 1992, pelo pesquisador August Böck. No entanto, em seu projeto de doutorado, a pesquisadora do IFSC, Lívia Manzine, observou, através de testes em soluções, que a quantidade de tRNAs ligantes na SelA eram 10.
Diante desta discrepância, Lívia, Vitor e o pesquisador do Laboratório Nacional de Nanotecnologia (LNNano), Rodrigo Portugal, resolveram unir esforços para desvendar o impasse em questão. Através da técnica de microscopia eletrônica de transmissão, utilizando “contraste negativo”* e da análise, conhecida por Principal Component Analysis (PCA), os pesquisadores chegaram aos mesmos resultados dos testes de solução e confirmaram que a SelA possuía, de fato, 10 tRNAs ligantes, e não cinco, como afirmado em 1992. “Com o resultado correto em mãos, escrevemos um artigo, que foi publicado pela FEBS [Federation of European Biochemical Societies]”, relembra Vitor.
Após essa elucidação, Vitor continuou o aperfeiçoamento do trabalho. Com o intuito de obter um modelo estrutural da macromolécula em alta resolução, o doutorando se utilizou de outra técnica, pouco difundida no Brasil até o momento: a Cryo-Electron Microscopy. A técnica consiste no congelamento de moléculas (já em solução) em etano líquido. Uma vez congeladas, é possível analisar as imagens de transmissão das moléculas, utilizando-se um microscópio eletrônico de transmissão, algo que se assemelha a uma “sombra” da molécula congelada. Com a soma de todas as projeções é possível reconstruir a estrutura tridimensional. “Essa técnica aprendi durante um estágio que fiz no NeCEN**, que durou cinco semanas. Levei duas amostras do complexo SelA para fazer as medidas em preparo crio e atualmente estou processando esses dados, que serão utilizados para o desvendamento da estrutura tridimensional da SelA”, explica Vitor.
Com a coleta de dados mais detalhada e um estudo mais aprofundado sobre o assunto, a meta que ainda permanece nos trabalhos de Vitor é a chance de se descobrir a função e importância da presença da SelA em bactérias e a diferença para os demais organismos, como dito no início desta matéria. Descoberta recentemente (em 1987), os principais estudos relacionados à SelA são referentes às vias nas quais é participante. “Já se sabe que o aminoácido selenocisteína não é adquirido na alimentação. No metabolismo das bactérias, a SelA recebe Selênio [Se] e o incorpora a um aminoácido já presente no tRNA específico, formando a selenocisteína, que já vai para o ribossomo. A grande pergunta é: por que as bactérias possuem esse complexo tão grande, podendo, inclusive, ser visualizado no microscópio, para fazer essa função específica, e nos outros organismo mais evoluídos ele desaparece?”.
De acordo com Vitor, uma das propostas é que a formação da SelA consome muita energia do metabolismo e alguns estudos indicam que a ausência da mesma em outros organismos pode ter sido, justamente, um passo evolutivo relacionado ao melhoramento desse gasto energético. “Ao se observar uma arqueia, próximo organismo evoluído após a bactéria, já foi encontrado o gene da SelA, mas o complexo não é formado, e nos seres humanos esse gene sequer existe”.
A propagação da nova metodologia
No momento, Vitor integra a equipe de Rodrigo Portugal, no LNNano, responsável pelo estudo mais aprofundado da SelA através da técnica de Cryon-Electron Microscopy. “A ideia é implementar, efetivamente, essa técnica, e já existem alguns usuários no Brasil, atualmente, que estão começando a utilizá-la”, conta.
 O estudo em questão rendeu a Vitor o prêmio de melhor pôster na 24ª Reunião Anual do Congresso da Sociedade Brasileira de Microscopia e Microanálise (CSBMM). Sobre essa conquista, o pesquisador diz que a descoberta, em si, não foi o maior mérito do trabalho, mas sim a utilização da técnica de crio. “O meu pôster foi um dos mais inusitados do Congresso, pois a maioria mostrava imagens de células, enquanto o meu era a imagem de uma proteína”, relembra. “Acho que por isso que ganhamos o prêmio, porque utilizamos uma metodologia diferente, quase desconhecida no Brasil”.
O estudo em questão rendeu a Vitor o prêmio de melhor pôster na 24ª Reunião Anual do Congresso da Sociedade Brasileira de Microscopia e Microanálise (CSBMM). Sobre essa conquista, o pesquisador diz que a descoberta, em si, não foi o maior mérito do trabalho, mas sim a utilização da técnica de crio. “O meu pôster foi um dos mais inusitados do Congresso, pois a maioria mostrava imagens de células, enquanto o meu era a imagem de uma proteína”, relembra. “Acho que por isso que ganhamos o prêmio, porque utilizamos uma metodologia diferente, quase desconhecida no Brasil”.
As consequências do trabalho são ainda imprevistas, mas Vitor acredita que, a partir de agora, a nova técnica ganhará maior notoriedade no meio acadêmico e de pesquisa. “Houve três pesquisadores, no CSBMM, que proferiram palestras sobre esse assunto, ou seja, a técnica já está sendo difundida e o prêmio veio para fechar essa ideia”, comemora Vitor.
* recobrimento das partículas na grade de microscopia utilizando um sal metálico a fim de aumentar o contraste da amostra.
** Netherlands Centre of Electron Nanoscopy (Leiden-Holanda)
Assessoria de Comunicação




