
Figura 2 – A gota de Cloro-Potássio, sem vapor de água, tem cor prateada, com diâmetro aproximado de 5 mm. Na presença de vapor de água, ela adquire uma forte tonalidade amarelo-ouro [(c)…(f)]. É a água metálica. Em (g), a cor da película passa a ser bronze; em (h), roxo azulado e em (i), branco acinzentado (com a formação de hidróxidos alcalinos) (Crédito: P.E. Mason et al 3)
Desde pequenos aprendemos o quão perigoso é uma descarga elétrica se estivermos imersos na água. Quando uma tempestade se aproxima, devemos sair da piscina ou da água do mar. A água, como a encontramos na natureza, é uma boa condutora de eletricidade. Isso ocorre, porque a água é um ótimo solvente e nela encontramos sais minerais e outras substâncias dissolvidas. A água pura, formada somente por moléculas de H2O, é um isolante.
Para entendermos melhor a posição que a água ocupa como condutora elétrica, precisamos compará-la com outros materiais. A resistência elétrica R de um material é diretamente proporcional ao seu comprimento L e inversamente proporcional à secção transversal A do fluxo de carga elétrica, isto é, R = ρ L/A, onde ρ é a constante de proporcionalidade (que, na verdade, depende da temperatura) denominada resistividade elétrica. O inverso da resistividade é a condutividade elétrica σ = 1/ρ.
Na Tabela ao lado, apresentamos a condutividade elétrica (medida a 20oC) de alguns materiais 1.
Consultando a tabela, vemos que a condutividade elétrica é uma quantidade que varia por 32 ordens de 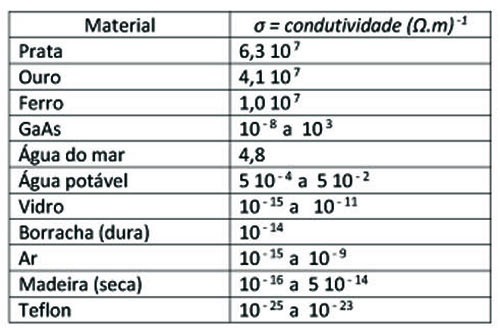 grandeza… de 10 – 25 a 10 7. Pela enorme densidade de elétrons livres, os metais encabeçam a lista como os melhores condutores elétricos; no centro, temos os semicondutores como o Arsenieto de Gálio e, fechando a tabela, temos os melhores isolantes elétricos como o Teflon. Vemos que a água ocupa uma posição intermediária.
grandeza… de 10 – 25 a 10 7. Pela enorme densidade de elétrons livres, os metais encabeçam a lista como os melhores condutores elétricos; no centro, temos os semicondutores como o Arsenieto de Gálio e, fechando a tabela, temos os melhores isolantes elétricos como o Teflon. Vemos que a água ocupa uma posição intermediária.
Tentativas de metalizar a água por aumento de pressão sobre o gelo, até aqui, não tiveram nenhum sucesso. Segundo Hermann et al. 2, a pressão necessária para obter água metálica é da ordem de 48 milhões de atmosferas!… um valor inacessível hoje nos laboratórios. Pressões dessa ordem de grandeza, só podem ser encontradas no interior de grandes planetas ou de estrelas.
Uma equipe internacional de cientistas3 encontrou uma alternativa muito criativa para o problema – conseguiram metalizar a água, lançando vapor de água diretamente sobre gotas de uma liga metálica de Sódio-Potássio. Essa liga é um metal alcalino (ou seja, é um grande doador de elétrons) e, à temperatura ambiente, se encontra no estado líquido. Dessa forma, eles puderam não só ver, mas também filmar, a transição de fase vapor de água – água metálica (veja vídeo 4).

Figura 1 – Na câmera de vácuo, a liga de NaK goteja num ritmo de 10 gotas/segundo. Quando vapor de água entra na câmera, a uma pressão de 10 -7 atmosferas, forma-se sobre a superfície da gota, uma fina camada de cor dourada – é a água metálica! (Crédito: HZB)
Metais alcalinos em contacto com a água formam uma mistura explosiva (veja vídeo 5). Para evitar isso, o experimento foi realizado no interior de uma câmera de vácuo, com um controle fino da entrada de vapor de água (veja Figura 1). Quando o vapor se deposita, forma uma camada fina sobre a gota de liga Sódio-Potássio, suprimindo dessa forma, a explosão. O bico goteja a uma razão de 10 gotas/segundo. Quando a pressão do vapor de água aumenta para cerca de 10 -7 atmosferas, ocorre a transição.
Entre a formação de uma gota e sua posterior queda, passam-se cerca de 10 segundos. Na Figura 2 (a), temos a gota da liga Sódio-Potássio na ausência total de vapor de água – ela é cor de prata, sem nenhuma mancha de outra cor e com diâmetro aproximado de 5 mm. Porém, na presença de vapor de água, entre 2 e 5 segundos após a sua formação, ela adquire uma forte tonalidade amarelo-ouro – estamos vendo uma película de água metálica!
Após 6 segundos, a cor da película passa a ser bronze, em seguida roxo azulado e, finalmente branco acinzentado. Esta última etapa, corresponde à formação de hidróxidos alcalinos em consequência da reação química da água com a liga metálica. A película transiente de água metálica apareceu em todas (centenas) gotas consecutivas, desde que a pressão fosse mantida em 10 -7 atmosferas.
A formação temporária (e não homogênea) da película de água metálica ocorre porque a velocidade com que a liga fornece elétrons é maior do que a velocidade de crescimento da camada de água, que foi estimada em cerca de 80 monocamadas por segundo3. Durante um certo tempo, a água está dopada com 5 1021 elétrons por centímetro cúbico.
Para caracterizar e comprovar que a película de água estava no estado metálico, a equipe iluminou as gotas de Sódio-Potássio (NaK) e coletou a luz refletida num espectrômetro que detectava da luz visível até a luz ultravioleta. Depois de subtrair o espectro devido à lâmpada, eles compararam o espectro da luz refletida sem e com a presença de vapor de água. Na presença de vapor de água, um pico de absorção de luz, bem proeminente, surge a 2,74 eV, que corresponde a uma frequência plasmônica de 664 THz (no visível, violeta). Na superfície de metais, o acoplamento de uma onda eletromagnética com o movimento de elétrons livres ou de condução, gera um movimento oscilatório que pode entrar em ressonância. O valor crítico, em que essa ressonância ocorre, é chamado de frequência plasmônica. Nessa frequência, a luz é quase totalmente absorvida, não havendo, praticamente, reflexão. Para o NaK puro, o pico de absorção ocorre em 4,5 eV, que corresponde a uma frequência plasmônica de 1091 THz (ultravioleta).
Utilizando as facilidades do sincrotron BESSY II, em Berlim, eles realizaram medidas de espectroscopia fotoeletrônica de raios-x. A energia de raios-x utilizada foi de 330 eV. Como no caso do experimento com reflexão de luz, eles estudaram o NaK com e sem a presença de vapor de água. A largura de banda de condução encontrada foi de 2,7 eV e 1,1 eV, respectivamente.
Conforme declarou R. Seidel, supervisor do experimento no sincrotron BESSY II, “Você pode ver a transição de fase para a água metálica a olho nu! A gota de Cloro-Potássio prateada se cobre de um brilho dourado, é muito impressionante!”
*Físico, Professor Sênior do IFSC – USP
(Agradecimento: ao Sr. Rui Sintra da Assessoria de Comunicação)
Referências:
1 Electrical resistivity and conductivity – Wikipedia
2 A. Hermann et al., Proc. Natl Acad. Sci. USA 109, 745–750 (2012),
https://doi.org/10.1073/pnas.1118694109
3 P.E. Mason et al., Nature, volume 595, 673–676 (2021)
DOI: 10.1038/s41586-021-03646-5
4 Veja o filme em
https://www.youtube.com/watch?v=DlDb_zWZC_w&feature=emb_rel_pause
5 Metais Alcalinos: Reações Com Agua – YouTube
Assessoria de Comunicação – IFSC/USP




