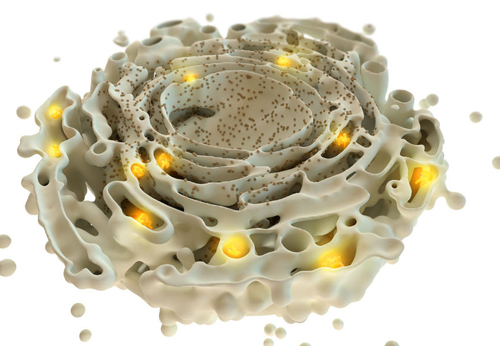
Proteínas mal enoveladas (laranja) no Retículo Endoplasmático -responsáveis pelo mal de Wolfram (Crédito: V. ALTOUNIAN/SCIENCE)
Por: Prof. Roberto N. Onody *
A síndrome de Wolfram é uma doença hereditária fatal e muito rara. Estima-se que cerca de 15.000 a 30.000 pessoas, em todo o mundo, sejam portadoras desse mal 1.
Durante a Grande Depressão na década de 30, quatro crianças diagnosticadas com diabetes e que estavam ficando cegas, foram examinadas pelo Dr. Donald Wolfram em Rochester, Minnesota. Ele e seu colega oftalmologista, descartaram a hipótese de uma dieta pobre e de má nutrição (à época, o diagnóstico prevalecente) dessas crianças, como causadoras dos sintomas. Em 1938, eles concluíram que os sintomas eram “uma manifestação hereditária ou lesão cerebral adquirida”.
A síndrome de Wolfram é uma doença de corpo inteiro. Seu primeiro sintoma, é o diabetes mellitus ou diabetes do tipo 1, um distúrbio metabólico causado pelo excesso de glicose no sangue (em geral, pela baixa produção de insulina no pâncreas). O diabetes já se manifesta nos primeiros anos de vida. A maior parte dos pacientes também desenvolvem o Diabetes insipidus, quando a glândula pituitária não produz hormônios suficientes para o balanceamento do fluido corporal, levando os rins a produzirem níveis elevados de urina. A doença ataca também o cerebelo, levando à perda de coordenação e controle do movimento. À medida que a doença progride, o paciente passa a ter perda de visão, surdez, dificuldade de respirar, de caminhar e de engolir. A maior parte dos portadores da síndrome Wolfram morrem antes completar 40 anos de idade.
Por ser uma doença rara, é muito difícil angariar fundos para financiar o seu estudo. Porém, em anos recentes, isso vem se alterando. Descobriu-se que o principal responsável pela síndrome é o mal funcionamento do reticulo endoplasmático ou ergastoplasma (Figura 1). O reticulo endoplasmático (RE) é uma organela da célula que participa da formação final de proteínas, enovelando-as. Cerca de 1/3 das proteínas ganham sua forma correta ali.
No ser humano, de 20 a 25 mil genes codificam perto de 2 milhões de proteínas. O gene WFS-1 é o responsável pela proteína wolframina. Uma mutação recessiva nesse gene, faz com que a wolframina se enovele incorretamente no RE. O acúmulo de wolframinas mal enoveladas, leva ao chamado estresse do RE. Mas, o estresse do RE é, sabidamente, uma condição também existente em várias outras doenças como o diabetes tipo 2, mal de Parkinson, mal de Alzheimer e a esclerose lateral amiotrófica. Por conseguinte, investigar a síndrome de Wolfram também auxiliará no estudo e na compreensão daquelas outras doenças.
A síndrome de Wolfram é uma doença monogênica progressiva. Por ser monogênica é muito mais ‘simples’ estudá-la. Segundo Fumihiko Urano, da Escola de Medicina da Universidade de Washington, “A síndrome de Wolfram é o protótipo de uma desordem no retículo endoplasmático”. É um laboratório para se investigar o estresse do RE. Quando as células não conseguem aliviar esse estresse, elas se autodestroem. Daí o porquê de tantos neurônios e células beta (que sintetizam a insulina) mortas.
Segundo a fisiologista Barbara Ehrlich, da Escola de Medicina de Yale, a wolframina defeituosa pode afetar as células de uma outra maneira. O RE, continuamente, absorve e libera íons de cálcio. Na presença da wolframina malformada, o fluxo de cálcio se desregula levando, por exemplo, à contração das células do músculo do coração. Nessa mesma linha, uma equipe da Agência Francesa de Pesquisa Biomédica (INSERM) descobriu que, nas células dos portadores da síndrome de Wolfram, a mitocôndria recebia menos cálcio do RE, produzindo, então, menos energia e desencadeando, eventualmente, a morte das células do nervo ótico.
Testes clínicos com o relaxante muscular Dantrolene começaram em 2016. Em muitos pacientes, as células beta melhoraram seu desempenho aumentando a produção de insulina, mas não houve nenhum benefício para a visão. Um outro experimento, realizado em 2018 no Reino Unido, testou, em laboratório, o medicamento Valproato de Sódio (usado, originalmente, para tratamento de epilepsia e desordem bipolar). Houve uma diminuição substancial da morte das células com malformação da wolframina. Em artigo publicado este ano, K. Seppa et al. 2, realizaram experimentos em ratos portadores da síndrome de Wolfram. Eles constataram que o tratamento com as drogas Liraglutida (utilizada para diabetes) e 7,8 Dihydroxyflavone impedia a progressão da perda de visão e do declínio cognitivo. Em alguns casos, os ratos apresentaram um aumento na acuidade visual e regeneração de neurônios.
Num ataque mais direto às causas do que aos efeitos da doença, estão em desenvolvimento duas linhas de pesquisas baseados em terapia genética.
Na primeira técnica, células de portadores da síndrome são levadas ao laboratório, onde são injetadas cópias de genes saudáveis (que produzem a wolframina corretamente enovelada). Em seguida, analisa-se se há restauração do funcionamento normal das células e redução da morte celular.
A segunda técnica, utiliza o editor de genoma CRISPR. CRISPR (que significa Clustered Regularly Interspaced Short Palindromic Repeats) é um avanço espetacular de engenharia genética que permite, localizar, remover e substituir genes em organismos vivos! As cientistas Doudna e Charpentier, receberam o Prêmio Nobel de Química de 2020, por esse desenvolvimento. A equipe de K. G. Maxwell 3, utilizando o editor CRISPR, removeu os genes defeituosos das células tronco de um paciente portador da síndrome de Wolfram, substituindo-os pela versão saudável. Essas células tronco foram, então, diferenciadas para se tornarem células beta e transplantadas em ratos com diabetes. Os animais retornaram a um nível saudável de açúcar no sangue, sem diabetes.
Esse experimento e seus resultados animadores, fazem da síndrome de Wolfram, um laboratório ideal para aplicar e se acompanhar o desenvolvimento de uma terapia genética. A morte das células, causada pelo mal enovelamento de proteínas, é bastante comum em doenças neurodegenerativas. Por exemplo, no mal Alzheimer, várias proteínas malformadas se acumulam tanto dentro quanto fora dos neurônios comprometidos. O tratamento por terapia genética é bem mais difícil, pois as proteínas envolvidas estão ligadas a múltiplos genes.
*Físico, Professor Sênior do IFSC – USP
(Agradecimento: ao Sr. Rui Sintra da Assessoria de Comunicação)
Referências
Mitch Leslie, doi:10.1126/science.abh0281
K.Seppa et al. Scientific Reports volume 11, 2275 (2021)
10-G. Maxwell et al., DOI: 10.1126/scitranslmed.aax9106
Assessoria de Comunicação – IFSC/USP
*Físico, Professor Sênior do IFSC – USP
Agradecimento: ao Sr. Rui Sintra da Assessoria de Comunicação
Referências:



