Na década de 70, o pesquisador Alfred W. Senft e seus colaboradores dedicavam tempo expressivo tentando saber mais sobre o parasita Schistosoma mansoni, causador da esquistossomose, doença infecciosa que, de acordo com a Organização Mundial de Saúde (OMS), infecta 230 milhões de pessoas todo ano. Concentrados em seus estudos, eles descobriram que o Schistosoma mansoni, uma das espécies do platelminto causador da doença mortal, era incapaz de produzir purinas, base nitrogenada responsável pela produção de moléculas energéticas e formação do DNA, dependendo assim, da chamada ” via de salvação de purinas”.
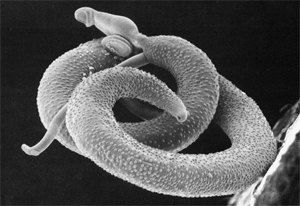 Não conseguir sintetizar purinas, moléculas precursoras na formação do DNA, era uma ótima notícia, exceto, obviamente, para o Schistosoma, que produz uma média de 300 ovos por dia e, consequentemente, precisa de muito DNA para continuar espalhando sua espécie.
Não conseguir sintetizar purinas, moléculas precursoras na formação do DNA, era uma ótima notícia, exceto, obviamente, para o Schistosoma, que produz uma média de 300 ovos por dia e, consequentemente, precisa de muito DNA para continuar espalhando sua espécie.
Para driblar esse “contratempo”, o parasita encontrou uma maneira simples: alojar-se num hospedeiro capaz de lhe conceber moléculas precursoras capazes de suprir a deficiência de purinas e, por sua vez, produzir energia e DNA necessários ao organismo do parasita.
Essa descoberta, feita há mais de 40 anos, foi um dos pontapés iniciais para os estudos do pesquisador do Grupo de Cristalografia (GC) do Instituto de Física de São Carlos (IFSC/USP), Humberto D´Muniz Pereira, nas pesquisas relacionadas à esquistossomose. Envolvida diretamente nesse estudo desde seu mestrado, a doutoranda do GC, Juliana Roberta Torini de Souza, junto a outros colaboradores do grupo, fez uma triagem de proteínas candidatas a fazer a conversão de adenosina à adenina em S. mansoni, uma vez que na via de salvação em humanos não é encontrada uma proteína capaz de realizar tal conversão de forma direta.
Alguns anos de estudo depois, Juliana encontrou duas fortes candidatas: purina-nucleosídeo fosforilase (PNP2) e a metiltioadenosina fosforilase (MTAP), esta última ganhando mais atenção da pesquisadora. “No início da pesquisa do mestrado, não sabíamos se existia uma proteína capaz de converter adenosina em adenina de forma direta na via de salvação de purinas em S. mansoni. Então, começamos a trabalhar com a MTAP, uma proteína da via de síntese de poliaminas*, que em alguns organismos, já havia demonstrado capacidade de fazer tal conversão, apesar de ter como substrato natural a metiltioadenosina (MTA)”.
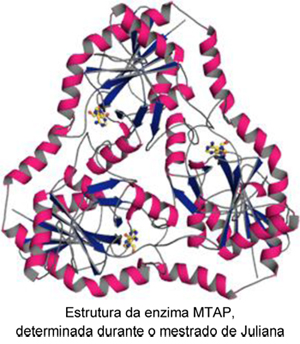 A MTAP, inclusive, é uma proteína comum ao Schistosoma mansoni e ao ser humano. Porém, a afinidade dessa proteína por seu substrato alternativo no Schistosoma foi uma das surpresas que Juliana encontrou durante sua pesquisa: ao fazer os chamados “ensaios cinéticos” com a MTAP, ou seja, medir a relação da proteína e seu nível de atividade no Schistosoma mansoni, ela verificou que a afinidade da proteína do parasita por adenosina mostrou-se 100 vezes maior do que a mesma proteína no organismo humano.
A MTAP, inclusive, é uma proteína comum ao Schistosoma mansoni e ao ser humano. Porém, a afinidade dessa proteína por seu substrato alternativo no Schistosoma foi uma das surpresas que Juliana encontrou durante sua pesquisa: ao fazer os chamados “ensaios cinéticos” com a MTAP, ou seja, medir a relação da proteína e seu nível de atividade no Schistosoma mansoni, ela verificou que a afinidade da proteína do parasita por adenosina mostrou-se 100 vezes maior do que a mesma proteína no organismo humano.
Depois de encontrar um número tão surpreendente como esse, o GC determinou a estrutura da MTAP e dentro de seu sítio ativo, ou seja, região onde ocorrem as reações químicas na proteína, foram encontradas duas mutações cruciais, que Juliana acredita serem as responsáveis por aumentar a afinidade por adenosina . “Acreditamos que essas duas mutações é que dão estas características à proteína do Schistosoma“.
Para ter certeza total da informação acima, alguns ensaios ainda precisam ser feitos. No momento, Juliana tem em mãos quatro estruturas da MTAP: duas determinadas no Laboratório Nacional de Luz Síncrotron (Campinas-SP) e duas no Diamond Light Source, um síncrotron situado em Harwell na (Inglaterra).
Leque aberto
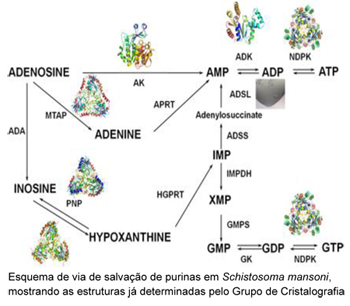
O projeto de Juliana se insere em um projeto maior, o Purinoma, que tem por objetivo determinar a estrutura de diversas proteínas chaves da via de salvação de purinas em S. mansoni e entender como cada uma das reações químicas são catalisadas. “Se conseguirmos entender a função de todas as proteínas presentes na via de salvação, conseguiremos elaborar planos para bloqueá-las, impedindo o acesso do Schistosoma mansoni às moléculas precursoras”, explica a pesquisadora.
Numa linguagem mais fácil, na via de salvação de purinas o Schistosoma pode usar vários “caminhos” para conseguir ferramentas para sintetizar DNA e moléculas energéticas. Se for desenvolvido um medicamentos capaz de bloquear apenas um desses “caminhos”, o parasita poderá utilizar os demais e o bloqueio dessa via, que parece ser de extrema importância para o parasita, não será efetivo. Portanto, estudando todas as proteínas (que funcionam como ponte desses caminhos) e determinando suas estruturas será possível bloquear todos os possíveis “caminhos” ou os mais importantes, e consequentemente bloquear a via como um todo, o que poderia diminuir a formação dos ovos e, até mesmo, causar a eliminação do Schistosoma do organismo humano.
 O resultado final, como a maioria dos esperados em pesquisas que tem como foco a cura de doenças infecciosas, é criar futuramente um medicamento mais eficaz contra o Schistosoma mansoni. Sobre isso, as perspectivas de Juliana são boas.
O resultado final, como a maioria dos esperados em pesquisas que tem como foco a cura de doenças infecciosas, é criar futuramente um medicamento mais eficaz contra o Schistosoma mansoni. Sobre isso, as perspectivas de Juliana são boas.
Contando com a colaboração do laboratório britânico Diamond Light Source, de acordo com a pesquisadora, em um ano, o GC, possivelmente, já terá determinado as estruturas de todas as proteínas da via de salvação. “Depois disso, faremos mais ensaios cinéticos para saber como as proteínas trabalham, o funcionamento de seu mecanismo e como realiza suas atividades”.
A maneira mais efetiva ( e não científica) de bloquear o parasita, contudo, seria o investimento em saneamento básico, uma vez que o contágio com o parasita Schistosoma mansoni se dá através do contato humano com a forma imatura do adulto (os ovos são eliminados pelas fezes do paciente contaminado). Mas, já que a melhora do saneamento parece uma possibilidade mais remota, a esperança fica voltada mais uma vez para a pesquisa, por forma a acabar de uma vez por todas com este mal.
*moléculas presentes em plantas, animais e micro-organismos
Assessoria de Comunicação



