
Pesquisadores responsáveis pelo trabalho no Sirius, a nova fonte de luz sincrotron brasileira, durante uma das coletas de dados que levaram ao trabalho. Da esquerda para direita Mariana Ortiz, Gabriela Noske, Andre Godoy (Pesquisador responsável pelo projeto), Glaucius Oliva (Coordernador do CIBFar), Ellen Souza e Isabela Dolci.
Pesquisadores do CIBFar investigam ação das variantes da protease
Desde 2016 que os laboratórios do CIBFar, um CEPID da FAPESP alocado no Instituto de Física de São Carlos (IFSC/USP) sob a coordenação do Prof. Glaucius Oliva, desenvolvem um trabalho ativo voltado ao desenvolvimento de novos medicamentos para o combate a diversos vírus, com uma atuação intensa que foi concentrada no desenvolvimento de candidatos antivirais para o vírus Zika até o ano de 2020, ano em que todos os esforços passaram a estar concentrados no combate à pandemia da COVID-19. Uma vez mais, o CIBFar tomou a frente científica com o objetivo de encontrar novos fármacos para o tratamento dessa doença.
Em um desses projetos, liderado pelo pesquisador Andre Schützer de Godoy, o CIBFar tem buscado compreender como funcionam as proteases virais, que são fundamentais para o ciclo do vírus. Desde 2020 que a equipe do CIBFar tem obtido bastante sucesso nas pesquisas nessa área, sendo que em 2021, entre outros estudos que foram feitos, emergiu o primeiro trabalho utilizando o Sincrotron brasileiro, o SIRIUS (https://revistapesquisa.fapesp.br/foi-uma-honra-sermos-os-primeiros-usuarios-externos-do-sirius/). Agora, o grupo tenta entender como novos medicamentos desenvolvidos contra esses alvos afetam as proteases em um nível estrutural, e também tentar entender como variantes do Coronavírus que já estão em circulação podem comprometer a eficácia desses medicamentos.
O que é a protease e como ela age
O Coronavírus é usualmente conhecido pela imagem de uma esfera coberta por espinhas (as chamadas Spikes). De fato, essa imagem mais não é do que uma espécie de envelope que contém no seu interior o material genético do vírus. “Quando esse vírus chega nas células e após as Spikes reconhecerem os receptores, ele “joga” esse material genético dentro delas, sequestrando toda a “maquinaria celular”. Esse material produz algumas proteínas que são essenciais para a sobrevivência e disseminação do vírus pelo organismo, sendo que dentre essas proteínas está a protease. Essa é a proteína que se transformou em um alvo óbvio para o desenvolvimento de novos medicamentos contra a doença, como os dois medicamentos aqui estudados”, pontua Andre Godoy.
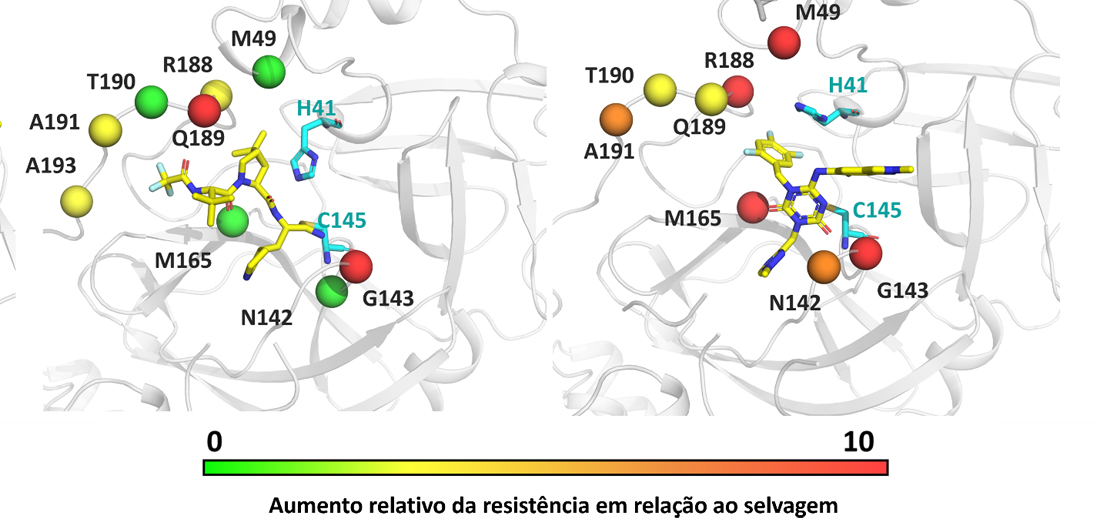
Figura mostra as posições das mutações onde foram identificados focos de resistência para os antivirais
Novos medicamentos e a ameaça das variantes da protease
O “Paxlovid” e o “Ensitrelvir” foram os dois medicamentos lançados mundialmente em finais do ano passado para combater a COVID-19. O primeiro, lançado pela Pfizer e já contando com a aprovação do FDA e da ANVISA, e o segundo, desenvolvido pela farmacêutica japonesa Shionogi, mas ainda sem aprovação pelas principais agências mundiais, têm como ponto negativo o alto custo para os pacientes. Apesar de diferentes, ambos os fármacos agem no mesmo alvo do vírus – a protease. O trabalho que a equipe desenvolveu foi exatamente sobre o princípio ativo desses dois medicamentos, tendo sua equipe buscado nos bancos de dados genômicos – cerca de 7 milhões de genomas – as variantes que existem dessa protease próximas ao sítio ativo – apenas 16 – produzido cada uma delas em laboratório e verificando como elas se comportam frente aos medicamentos.
Dois medicamentos concentrados em um só

Pesquisador Andre Schutzer de Godoy do CIBFar, que coordenou o projeto
“Nesta pesquisa encontramos duas coisas muito interessantes. A primeira foi que algumas dessas variantes já em circulação parecem ser resistentes a um desses medicamentos, ou seja, podem comprometer a eficácia no tratamento da COVID-19 por meio da geração de resistência. Além disso, observamos que uma mesma variante não parece ser resistente a ambos os medicamentos. Em virtude de os dois fármacos serem ligeiramente diferentes do ponto de vista estrutural – e aqui falamos do aspecto químico – esses dados podem indicar que a combinação dos dois fármacos possa ser um boa maneira de evitar resistência”, sublinha o pesquisador acrescentando ainda que a caracterização estrutural dessas variantes foi realizada através de cristalografia de raios-x, onde se utilizou novamente o SIRIUS para esse fim. Dessa forma, a equipe de Andre Godoy conseguiu resolver as questões relacionadas com as sete principais variantes que mostravam resistência aos medicamentos, sendo que isso permitiu compreender em um nível molecular o que provocava a resistência.
O pesquisador do CIBFar admite que este é um trabalho bastante importante, sublinhando a forte parceria que foi feita com o SIRIUS e cujos resultados foram obtidos há cerca de seis meses. Em termos clínicos e através deste trabalho, Andre Godoy acredita que se abrem portas para que, no futuro, se possam realizar estudos e pesquisas que promovam a combinação destes dois medicamentos – ou de outros com as mesmas características – em um só, de forma que se evite a formação de linhagens resistentes. “O CIBFar vai permanecer muito atento a estas variantes resistentes de protease, embora elas não constituam uma preocupação ou ameaça em larga escala, por enquanto”, conclui o pesquisador.
(Confira AQUI o artigo científico)
Rui Sintra – Assessoria de Comunicação – IFSC/USP




